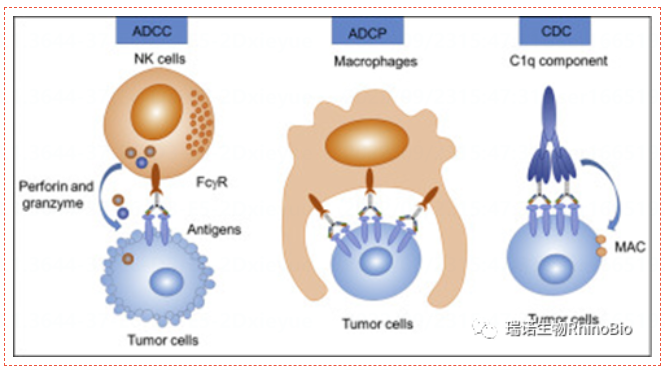
随着基因工(gōng)程、分(fēn)子生物(wù)學(xué)和基因組學(xué)的研究發展,生物(wù)技(jì )術藥物(wù)也迅速發展起來。抗體(tǐ)藥物(wù)已經成為(wèi)發展最快的治療性藥物(wù)。抗體(tǐ)是由Fab片段和Fc片段兩個部分(fēn)組成。Fab片段與抗原結合發揮作(zuò)用(yòng),Fc片段通過與免疫細胞上表達的FcγR相互作(zuò)用(yòng),從而激活效應細胞的吞噬作(zuò)用(yòng)和補體(tǐ)效應等多(duō)種免疫途徑,從而殺傷腫瘤細胞。除免疫檢查點靶向外,ADCC、ADCP和CDC是抗體(tǐ)介導免疫治療的重要機制(如下圖)。對于ADCC和ADCP,在結合靶抗原後,抗體(tǐ)的Fc段募集FcγR表達的效應細胞,包括NK細胞和巨噬細胞,并誘導釋放細胞毒性顆粒和吞噬作(zuò)用(yòng)以增強變異細胞的清除。對于CDC,一旦抗體(tǐ)的Fc部分(fēn)與C1q結合,一系列補體(tǐ)就會被激活并産(chǎn)生膜攻擊複合物(wù)(MAC),該複合物(wù)可(kě)以通過破壞細胞膜來殺死靶細胞。

傳統的依賴于NK細胞毒性ADCC檢測過程分(fēn)為(wèi)三個重要組成部分(fēn):單抗藥物(wù)、效應細胞和靶細胞。因此,體(tǐ)外實驗一般包括靶細胞的确定(細胞表面高表達單抗可(kě)識别抗原)、效應細胞的選擇和靶細胞活性的檢測。
1、效應細胞
衆所周知,ADCC/ADCP 主要由NK細胞驅動。因此,傳統的ADCC/ADCP的檢測會使用(yòng)原代NK細胞作(zuò)為(wèi)效應細胞檢測靶細胞的殺傷或者吞噬效應。原始的NK細胞需要單獨或者從人血液中(zhōng)分(fēn)離的外周血單核細胞(PBMC)培養物(wù)中(zhōng)獲取,原代細胞被認為(wèi)最接近生理(lǐ)環境,但基于它們的測定容易出現供體(tǐ)間的變異以及自身變異,從而導緻ADCC的檢測重複性差。
2、靶細胞
通常會選擇腫瘤細胞或者過表達靶點的細胞系作(zuò)為(wèi)靶細胞。
3、檢測方法
(1)将具(jù)有(yǒu)放射性的鉻51與靶細胞孵育,鉻51會進入靶細胞;洗去多(duō)于未進入細胞的鉻51,再将靶細胞和效應細胞以及抗體(tǐ)共同孵育。如果靶細胞被殺傷,鉻51就會被釋放出來,檢測溶液中(zhōng)的放射性同位素含量即可(kě)确認靶細胞被殺傷的情況。該方法是ADCC檢測靶細胞被殺傷的金标準,然而因為(wèi)帶有(yǒu)放射性元素、費時費力且實驗變化性大而較少使用(yòng)。(2)靶細胞被殺傷後細胞膜破損,靶細胞内的乳酸脫氫酶(LDH)或蛋白酶(Protease)會釋放到上清液中(zhōng),可(kě)以通過定量檢測這些物(wù)質(zhì)的含量來評估靶細胞被殺傷的程度。現有(yǒu)的檢測乳酸脫氫酶的方法有(yǒu)比色法、熒光法和生物(wù)發光法等。(3)選擇一種染料标記靶細胞(例如,CFSE),另一種染料标記死細胞(例如,FVD),利用(yòng)流式細胞儀來定量死亡的靶細胞(兩種染料均發光)的含量,從而評估靶細胞的殺傷能(néng)力。
近些年,随着基因工(gōng)程的發展,報告基因法逐漸應用(yòng)于抗體(tǐ)藥物(wù)的生物(wù)學(xué)活性檢測,下面表格中(zhōng)列舉了報告基因法在生物(wù)藥活性檢測方面的應用(yòng)。

報告基因法是利用(yòng)分(fēn)子生物(wù)學(xué)手段,将報告基因整合到待檢測的細胞中(zhōng),通過檢測報告基因産(chǎn)生的信号來研究特定的生物(wù)學(xué)過程。抗體(tǐ)藥物(wù)發揮作(zuò)用(yòng)是通過誘導細胞産(chǎn)生生物(wù)學(xué)應答(dá),這個過程中(zhōng)涉及特定信号通路的活化和傳導,利用(yòng)報告基因法則可(kě)以通過報告基因信号的分(fēn)析,從而間接測定抗體(tǐ)藥的生物(wù)學(xué)活性。

1、檢測細胞的選擇
為(wèi)了構建穩定性高的方法,檢測所用(yòng)細胞一般選用(yòng)能(néng)夠穩定傳代的細胞系或細胞株,以方便報告基因的轉基因操作(zuò)和細胞的克隆化。由原代細胞或不穩定的細胞系構建的報告細胞,無法保證本次檢測時細胞的狀态一緻,也就無法準确、定量地反映待測藥品的質(zhì)量。同時,檢測用(yòng)細胞還要盡量考慮是待測藥物(wù)的靶細胞,藥物(wù)刺激與靶細胞産(chǎn)生的變化相關,這樣能(néng)更加真實地反映待測藥物(wù)的活性,也便于與其他(tā)方法進行比較。
2、報告基因的選擇
報告基因是編碼基因,其編碼産(chǎn)物(wù)可(kě)以是某些蛋白或酶類。選擇報告基因的原則,一是要考慮報告基因的表達是否對宿主細胞有(yǒu)影響,是否有(yǒu)内源性活性的幹擾;二是要考慮報告基因檢測信号的類型和相應的檢測方法是否成熟。常用(yòng)的報告基因有(yǒu)CAT (氯黴素乙酰基轉移酶) 、SEAP (分(fēn)泌型堿性磷酸酶) 、GFP (綠色熒光蛋白) 、β-半乳糖苷酶、GUS (葡萄糖醛酸酶) 等。但相對于其他(tā)報告基因,螢光素酶具(jù)有(yǒu)諸多(duō)優勢:檢測靈敏度高,如螢火蟲螢光素酶的檢測靈敏度可(kě)達10-20mol,靈敏度約為(wèi)CAT的100倍,信号半衰期可(kě)維持數小(xiǎo)時;檢測範圍寬,可(kě)達7~8個數量級;與β半乳糖苷酶相比,哺乳動物(wù)細胞無内源性螢光素酶活性;有(yǒu)多(duō)種商(shāng)品化螢光素酶檢測系統可(kě)選。
3、信号通路的選擇
藥物(wù)作(zuò)用(yòng)于細胞,細胞内會産(chǎn)生多(duō)種效應,最終表現可(kě)能(néng)是促進細胞增殖,或抑制細胞增殖、産(chǎn)生細胞毒效應或抗病毒效應等。在分(fēn)子層面上, 這些表型的背後勢必涉及多(duō)條信号通路的協同、競争和整合。因此,應盡量選擇與最終細胞表型相關、最能(néng)反映藥品藥理(lǐ)性質(zhì)的通路。
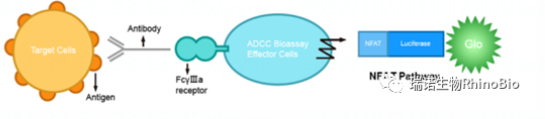
Rhinogen® ADCC Reporter Bioassay生物(wù)發光報告基因法,基于NFAT(Nuclear factor of activated T-cells)反應通路,采用(yòng)基因工(gōng)程改造的Jurkat細胞作(zuò)為(wèi)效應細胞,該細胞穩定表達FcγRIIIa受體(tǐ)(V158高親和力突變體(tǐ))和由NFAT應答(dá)元件驅動表達的螢火蟲螢光素酶。抗體(tǐ)通過與效應細胞表面FcγRIIIa的結合,激發細胞内NFAT反應元件,NFAT反應元件則驅動螢火蟲熒光素酶的表達。利用(yòng)熒光素酶活性檢測試劑實現定量分(fēn)析。

生物(wù)學(xué)活性的測定方法多(duō)種多(duō)樣,而報告基因法因其檢測靈敏度高、檢測周期短、檢測方法幹擾少被廣泛用(yòng)于生物(wù)藥的生物(wù)學(xué)活性檢測。報告基因法在2015版《中(zhōng)國(guó)藥典》被收錄為(wèi)Ⅰ型幹擾素活性測定的标準方法之一,基于此的生物(wù)學(xué)測定方法應用(yòng)範圍逐漸擴大,應用(yòng)前景廣闊。

 聯系我們
聯系我們 郵箱:sales@rhinobio.com
電(diàn)話:18912791908
參考文(wén)獻
[1] 牛安(ān)娜,蘇昕,張曉鵬.報告基因法在生物(wù)技(jì )術藥物(wù)活性檢測中(zhōng)的應用(yòng)[J].生物(wù)技(jì )術通訊,2019,30(02):296-300.
[2] W.Z Chen. Antibody and antibody fragments for cancer immunotherapy, Journal of Controlled Release Volume 328, 10 December 2020, Pages 395-406.
[3] https://www.1633.com/article/61489.html