
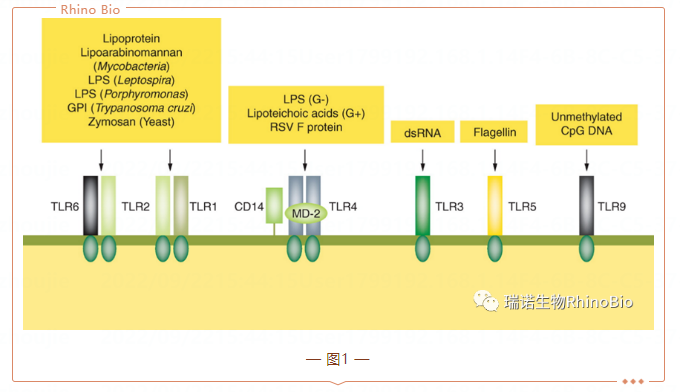
自從第一個皮下注射液上市以來,注射熱很(hěn)可(kě)能(néng)是注射的結果。現在,人們将引起恒溫動物(wù)體(tǐ)溫異常升高(發燒、休克或死亡等)的緻熱物(wù)質(zhì),稱為(wèi)熱原,可(kě)能(néng)是造成大多(duō)數早期發燒和腸外注射描述的其他(tā)附帶生物(wù)效應的原因。熱原包括内毒素和非内毒素熱原(NEP),細菌内毒素是最常見的熱原,也是醫(yī)藥工(gōng)業界安(ān)全生産(chǎn)所關心的問題。注射時,即使是微量的熱原,也會通過稱為(wèi)Toll樣受體(tǐ)(TLR)的一類蛋白質(zhì)觸發先天免疫反應。TLR是跨膜蛋白,主要在巨噬細胞和樹突狀細胞等所謂的前哨細胞中(zhōng)表達,它們在先天免疫系統的激活中(zhōng)起着至關重要的作(zuò)用(yòng)。它們充當模式識别受體(tǐ),由對微生物(wù)或病原體(tǐ)相關分(fēn)子模式以及内源性損傷相關分(fēn)子模式的識别觸發。迄今為(wèi)止,已知13種人類TLR,每一種都充當一種或幾種特定配體(tǐ)的受體(tǐ)。這種結合觸發了細胞内信号級聯反應,作(zuò)為(wèi)對潛在有(yǒu)害微生物(wù)或其他(tā)外源性物(wù)質(zhì)的第一反應的基礎(圖1)。

兔熱原測試(RPT)于1942年推出,是第一個也是唯一一個用(yòng)于檢測藥物(wù)和醫(yī)療産(chǎn)品中(zhōng)熱原的體(tǐ)内方法,到目前為(wèi)止,非腸道給藥的産(chǎn)品一般都以這種方式進行測試。RPT存在各種限制,例如:無法區(qū)分(fēn)不同的内毒素和NEP;對疫苗等固有(yǒu)緻熱藥物(wù)的反應隻能(néng)定性;無法應用(yòng)于非靜脈内給藥的藥物(wù);動物(wù)飼養和用(yòng)于測試所需要投入較多(duō)時間和精(jīng)力;而且最重要的是無法定量分(fēn)析。
基于鲎變形細胞裂解物(wù)(LAL)的内毒素檢測于1977年被美國(guó)FDA批準,之後幾年陸續被其他(tā)主流藥典批準。在藥物(wù)質(zhì)量控制中(zhōng),有(yǒu)三種主要的LAL方法用(yòng)于檢測和/或定量内毒素,根據它們的檢測機制命名(míng)。雖然它們是不同的方法,但它們都利用(yòng)鲎試劑來檢測内毒素,并依賴于相同的凝血級聯原理(lǐ)(圖2)。凝膠法是最原始的鲎試驗,也是目前藥典認可(kě)内毒素檢測的“金标準”。這是一種定性檢測方法,其中(zhōng)凝膠的凝結表明樣品中(zhōng)存在高于裂解物(wù)靈敏度的内毒素。其他(tā)兩種方法,比濁法和顯色法,都是通過标準曲線(xiàn)實現定量分(fēn)析。比濁法LAL測試将凝膠化速率(濁度)聯系起來,以确定樣品的内毒素濃度。顯色LAL測試使用(yòng)一種合成顯色底物(wù),該底物(wù)添加到試劑中(zhōng)并被凝血酶激活,從而産(chǎn)生比色讀數。
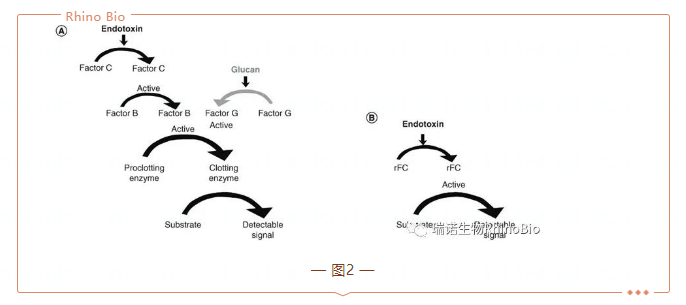
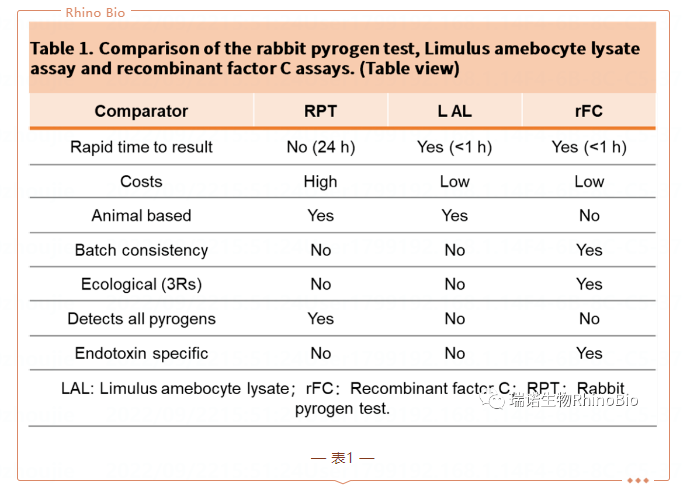
第一個市售的基于重組因子C(rFC)的内毒素檢測方法(BET)于2004年面世(圖2)。從那時起,其他(tā)rFC試劑也逐步進入市場,以提高可(kě)用(yòng)性以及産(chǎn)品和供應商(shāng)的範圍。rFC檢測使用(yòng)單一重組蛋白,因子C和小(xiǎo)熒光肽作(zuò)為(wèi)檢測試劑的一部分(fēn)。與其他(tā)重組生産(chǎn)的産(chǎn)品一樣,其生産(chǎn)标準化主要為(wèi)控制生産(chǎn)相同的rFC蛋白,并且已有(yǒu)實驗證明rFC比LAL批次間的可(kě)重複性高(表1)。另外,rFC檢測也不包含因子G,因此,它可(kě)以避免葡聚糖引起的G因子非特異性幹擾所造成的假陽性。

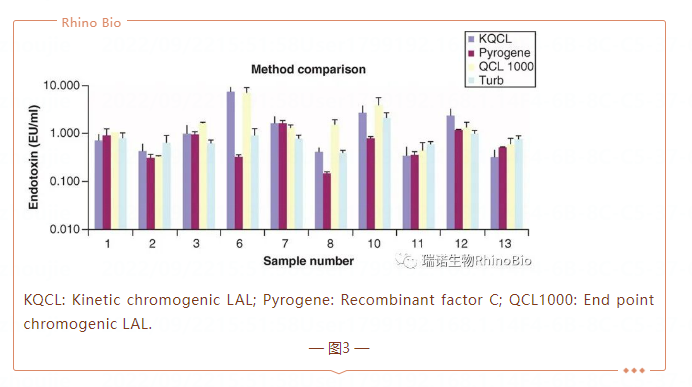
由于潛在的幹擾,蛋白質(zhì)樣品中(zhōng)内毒素的檢測可(kě)能(néng)具(jù)有(yǒu)挑戰性。輝瑞公(gōng)司2013年利用(yòng)所有(yǒu)市售鲎試劑測試方法(凝膠法、動力學(xué)比濁法、動力學(xué)顯色和終點顯色)以及rFC檢測了13個具(jù)有(yǒu)代表性的生物(wù)蛋白質(zhì)樣品(圖3)。在所有(yǒu)定量分(fēn)析中(zhōng),10個樣品的内毒素水平都可(kě)測量,rFC和LAL之間的檢測結果差異不大。

裴宇盛等人進行了rFC産(chǎn)品的适用(yòng)性。在四個實驗室的每一個都測試了三批六種不同藥品的适用(yòng)性和幹擾性。六個具(jù)有(yǒu)代表性的品種為(wèi):抗生素、生化藥物(wù)、重組原藥、中(zhōng)藥注射劑、病毒疫苗和單克隆抗體(tǐ)。研究得出的結論是,rFC對六種藥品具(jù)有(yǒu)良好的适用(yòng)性;所有(yǒu)18批次的加标回收率結果均在中(zhōng)國(guó)藥典要求的50-200%的可(kě)接受範圍内,并滿足幹擾測試要求。研究數據還用(yòng)于支持中(zhōng)國(guó)藥典在其最新(xīn)更新(xīn)中(zhōng)将rFC方法納入BET。

結果表明,基于rFC的内毒素檢測方法适用(yòng)于四種不同基質(zhì)特征的産(chǎn)品中(zhōng)的内毒素檢測。所有(yǒu)方法的參考标準均是要求内毒素(RSE)加标回收率(100EU/ml)在50–200%範圍内。該研究得出結論,LAL和rFC檢測都足以測試和放行四種疫苗産(chǎn)品。


郵箱:sales@rhinobio.com
電(diàn)話:18912791908
參考文(wén)獻
[1] Tindall,B.,Demircioglu, D., & Uhlig, T. (2021). Recombinant bacterial endotoxin testing: a proven solution. BioTechniques, 70(5), 290-300.